Что легче вступает в реакцию с металлом⁚ кислоты или щелочи?
Этот вопрос не имеет однозначного ответа, так как реакционная способность как кислот, так и щелочей зависит от конкретного металла, его активности, концентрации раствора и других факторов.
Кислоты и металлы
Кислоты, как известно, обладают способностью отдавать ионы водорода (H+) в растворе. Взаимодействие кислот с металлами приводит к образованию солей и выделению водорода. Эта реакция, известная как реакция замещения, происходит, когда металл более активен, чем водород в ряду активности металлов.
Например, при взаимодействии соляной кислоты (HCl) с цинком (Zn) образуется хлорид цинка (ZnCl2) и выделяется водород (H2)⁚
2HCl + Zn → ZnCl2 + H2
В данном случае цинк более активен, чем водород, поэтому он вытесняет его из кислоты, образуя соль.
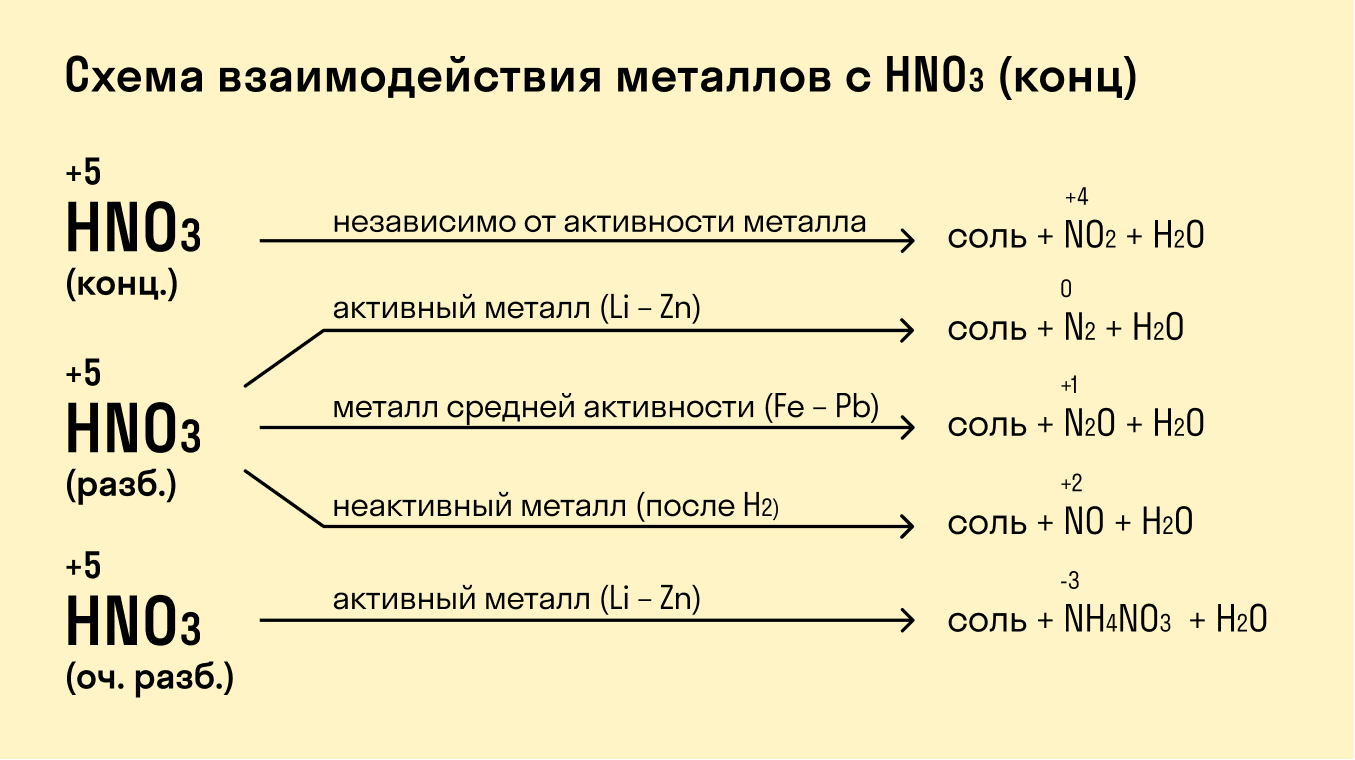
Важно отметить, что не все металлы реагируют с кислотами. Например, благородные металлы, такие как золото (Au) и платина (Pt), не вступают в реакцию с соляной кислотой. Для их растворения требуется более сильная кислота, например, царская водка (смесь концентрированной азотной и соляной кислот).
Скорость реакции между кислотой и металлом зависит от ряда факторов, таких как⁚
- Активность металла⁚ чем активнее металл, тем быстрее будет протекать реакция.
- Концентрация кислоты⁚ чем выше концентрация кислоты, тем быстрее будет протекать реакция.
- Температура⁚ повышение температуры ускоряет реакцию.
- Присутствие катализатора⁚ некоторые вещества, такие как ионы меди (Cu2+), могут ускорять реакцию.
Таким образом, реакция между кислотой и металлом является сложным процессом, который зависит от множества факторов.
Щелочи и металлы
Щелочи, также известные как основания, представляют собой химические соединения, которые в водном растворе диссоциируют с образованием гидроксид-ионов (OH—). Взаимодействие щелочей с металлами происходит по-другому, чем реакция с кислотами.
Щелочи, как правило, не вступают в реакцию с большинством металлов при комнатной температуре. Однако некоторые металлы, такие как алюминий (Al) и цинк (Zn), могут реагировать со щелочами, образуя гидроксиды металлов и водород.
Например, при взаимодействии гидроксида натрия (NaOH) с алюминием (Al) образуется гидроксид алюминия (Al(OH)3) и выделяется водород (H2)⁚
2NaOH + 2Al + 6H2O → 2Na[Al(OH)4] + 3H2
В данном случае алюминий реагирует с гидроксидом натрия, образуя комплексный ион [Al(OH)4]—, который растворяется в растворе.
Важно отметить, что реакция между щелочами и металлами, как правило, протекает медленнее, чем реакция между кислотами и металлами. Это связано с тем, что щелочи, как правило, менее активны, чем кислоты.
Кроме того, реакция между щелочами и металлами может быть затруднена образованием защитной пленки гидроксида металла на поверхности металла. Эта пленка препятствует дальнейшему взаимодействию металла со щелочью.
Таким образом, реакция между щелочами и металлами является более сложным процессом, чем реакция между кислотами и металлами. Она зависит от конкретного металла, концентрации щелочи, температуры и других факторов.
Сравнение реакционной способности
Сравнивая реакционную способность кислот и щелочей по отношению к металлам, можно сделать следующие выводы⁚
Кислоты, как правило, более активны в реакциях с металлами, чем щелочи. Это связано с тем, что кислоты содержат ионы водорода (H+), которые легко отщепляются и вступают в реакцию с металлами, образуя соли и водород.
Например, при взаимодействии соляной кислоты (HCl) с цинком (Zn) образуется хлорид цинка (ZnCl2) и выделяется водород (H2)⁚
2HCl + Zn → ZnCl2 + H2
Щелочи, как правило, менее активны в реакциях с металлами, за исключением некоторых реакций, описанных в предыдущей секции.
Однако, реакционная способность кислот и щелочей зависит не только от их химической природы, но и от других факторов, таких как⁚
- Активность металла⁚ Металлы, расположенные выше в ряду активности металлов, более активно реагируют с кислотами и щелочами. Например, натрий (Na) более активен, чем медь (Cu), поэтому он будет более активно реагировать с кислотами и щелочами.
- Концентрация раствора⁚ Чем выше концентрация кислоты или щелочи, тем быстрее будет протекать реакция.
- Температура⁚ Повышение температуры ускоряет большинство химических реакций, в т.ч. реакции между кислотами, щелочами и металлами.
- Присутствие катализатора⁚ Некоторые вещества могут ускорять реакции, действуя как катализаторы. Например, добавление катализатора может ускорить реакцию между кислотой и металлом.
Таким образом, сравнение реакционной способности кислот и щелочей по отношению к металлам является сложным вопросом, который требует учета многих факторов.
Факторы, влияющие на скорость реакции
Скорость реакции между кислотами, щелочами и металлами зависит от нескольких факторов, которые могут значительно влиять на ее протекание. Рассмотрим основные из них⁚
- Активность металла⁚ Активность металла является ключевым фактором, определяющим скорость реакции. Металлы, расположенные выше в ряду активности металлов, более склонны к реакциям с кислотами и щелочами. Например, щелочные металлы (Li, Na, K, Rb, Cs) реагируют с водой и кислотами очень быстро, выделяя водород.
- Концентрация кислоты или щелочи⁚ Чем выше концентрация кислоты или щелочи, тем больше ионов водорода (H+) или гидроксид-ионов (OH—) присутствует в растворе, что приводит к более быстрому протеканию реакции.
- Температура⁚ Повышение температуры увеличивает кинетическую энергию частиц, что приводит к более частым столкновениям и, следовательно, к увеличению скорости реакции.
- Присутствие катализатора⁚ Катализатор ускоряет реакцию, не участвуя в ней сам. Он снижает энергию активации реакции, что приводит к более быстрому протеканию. Например, добавление платины (Pt) может ускорить реакцию между кислотой и металлом.
- Поверхность контакта⁚ Чем больше поверхность контакта между металлом и кислотой или щелочью, тем быстрее будет протекать реакция. Измельчение металла или использование порошкообразной формы увеличивает площадь поверхности, что способствует более быстрому протеканию реакции.
- Присутствие окислителя⁚ Окислители могут ускорять реакции между металлами и кислотами, так как они способствуют отщеплению электронов от атомов металла, что делает их более реакционноспособными. Например, добавление азотной кислоты (HNO3) может ускорить реакцию между медью (Cu) и соляной кислотой (HCl).
Важно понимать, что эти факторы могут действовать как в отдельности, так и в сочетании, влияя на скорость реакции в различной степени.